Ces pages concernent les odonates d’Australie observés dans le Territoire du Nord (Northern Territory, le Top End) que j’abrégerai souvent « NT », et une toute petite partie de l’Australie-Occidentale (WA). Mais aussi, depuis décembre 2022, l’extrême nord du Queensland (Far North Queensland, FNQ).
Le nord, la région de Darwin et le fameux Parc National Kakadu est tropical, avec une saison sèche et une saison humide ; notre séjour se situait à la fin de la saison humide, du 12 avril au 5 mai 2022.
Plus au sud, c’est une région des savanes, avec des rivières, des billabongs (mares formées par les crues de la saison humides) et des ruisseaux ou torrents pérennes dans des zones rocheuses formant de magnifiques chutes et piscines (« rockholes »).
La présence humaine est sporadique dans ces immensités et la chaleur intense (34 à 39 °C) est certainement un frein à l’occupation du territoire.
Le Far North Queensland est une région tropicale humide, avec bananeraie et plantations de canne à sucre, forêt pluviale, et des reliefs qui atteignent 1400 m avec de très nombreuses petites rivières.
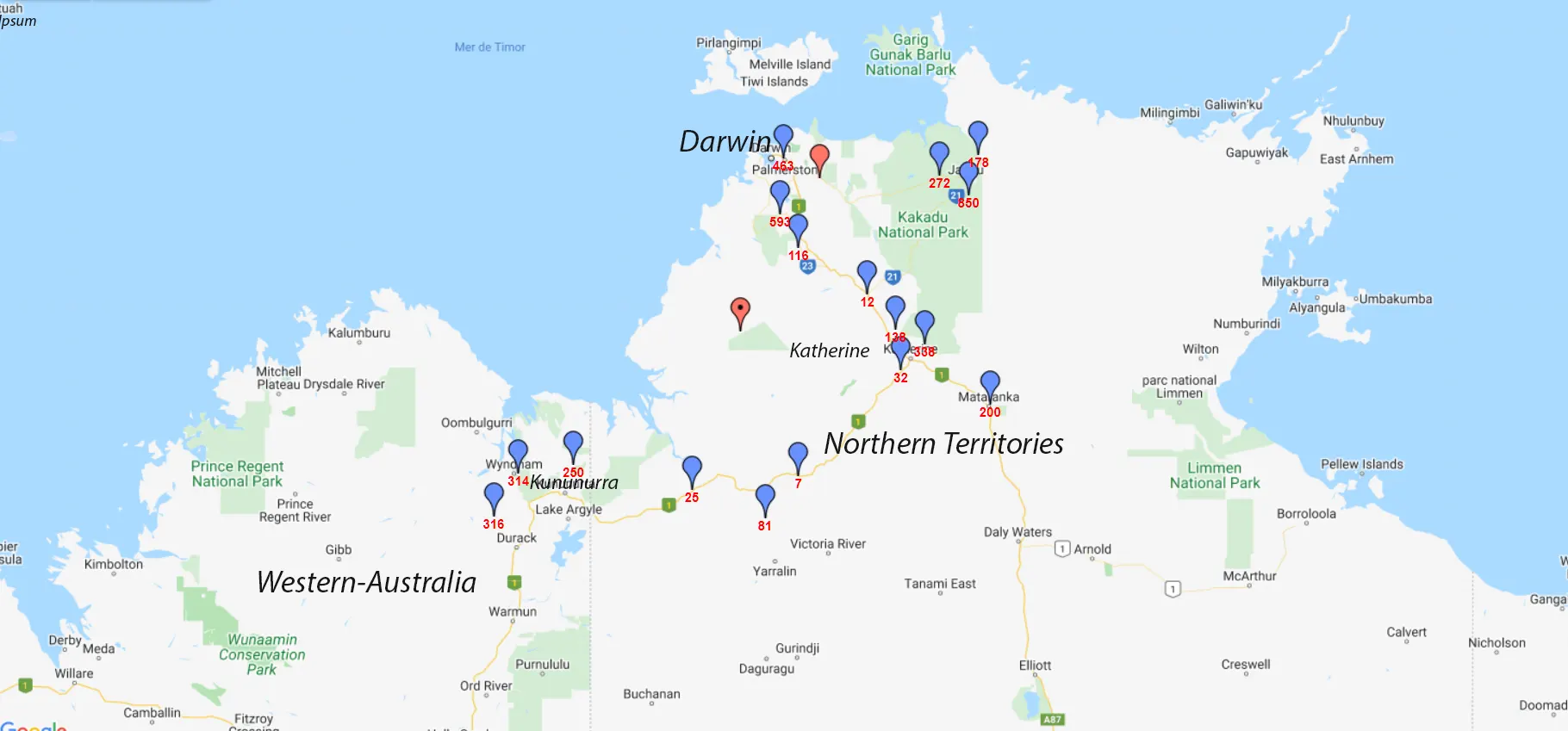
Carte des emplacements prospectés dans le Territoire du Nord
Très souvent, nous (Phil, Chris, Denis et moi) avons prospecté en forêt, le long des ruisseaux et les conditions de lumière sont souvent difficiles imposant le flash.
Pour l’identification de nos découvertes, il existe un ouvrage de terrain, The Complete Field Guide to Dragonflies of Australia par Günther Theischinger et John Hawking, dont je possède l’édition 2006 ; il a été mis à jour en 2021 et nous espérions tous que cette édition réparerait ses lacunes et serait illustrée de façon moderne et utile, avec des photos de terrain ou des dessins utilisables pour l’identification ; en restant aimable, on peut dire que ce guide a le mérite d’avoir été réédité…
C’est Phil Benstead, qui avait minutieusement préparé cette prospection, qui nous a apporté ses connaissances, en particulier pour le difficile genre Nososticta.
Ian Endersby a également publié en 2021 un Atlas de distribution qu’il m’a très gentiment envoyé : « The Distribution of Australian Dragonflies » dont la consultation est indispensable. Il faut cependant remarquer que ce travail est basé sur seulement 60.000 données de 325 espèces, ce qui rapporté à la taille de l’Australie est extrêmement faible ; l’Atlas de mon seul département, Maine-et-Loire, a reposé en 2013 sur 21700 données pour une soixantaine d’espèces. Les surprises étaient donc prévisibles.
Les Gomphidae nous ont fait faux bond dans le Territoire du Nord, sans doute notre séjour était-il trop tardif dans la saison.
Le bilan atteint tout de même 75 espèces (325 en Australie selon les derniers comptages), ce qui n’est pas en soi un score élevé en région tropicale ; cette région d’Australie n’est pas une des plus riches, mais certainement la moins prospectée puisque nous avons eu le privilège de rencontrer et d’immortaliser 3 espèces qui n’avaient jamais été photographiées !
Pour la région du Queensland, le bilan n’est pas encore établi et devrait atteindre la centaine d’espèces, un meilleur score pour les Gomphidae.
Au total, ce sont 124 espèces que j’aurais photographiées sur ces 2 séjours.
Il faut aussi insister sur le livre de Ian Endersby qui en collaboration avec Heinrich Fliedner s’est attaqué à l’étymologie des noms des libellules australiennes dans « The Naming of Australia’s Dragongflies » : c’est un ouvrage très intéressant auquel je ferai référence pour chaque espèce.
| Lestoideidae | Gomphidae |
| Diphlebia euphoeoides → | Antipodogomphus proselythus → |
| Diphlebia hybridoides → | Austroepigomphus turneri → |
| Lestoidea brevicauda → | Austrogomphus amphiclitus → |
| Lestoidea conjuncta → | Austrogomphus divaricatus → |
| Austrogomphus mjobergi → | |
| Chorismagrionidae | Austrogomphus prasinus → |
| Chorismagrion risi → | Hemigomphus comitatus → |
| Synlestidae | Hemigomphus theischingeri → |
| Synlestes tropicus → | Ictinogomphus australis → |
| Lestidae | Synthemistidae |
| Austrolestes leda → | Eusynthemis nigra → |
| Indolestes alleni → | Choristhemis flavoterminata → |
| Indolestes insularis → | Pseudocordulia circularis → |
| Indolestes tenuissimus → | Tonyosynthemis claviculata → |
| Lestes concinnus → | Corduliidae |
| Argiolestidae | Hemicordulia australiae → |
| Austroargiolestes aureus → | Hemicordulia continentalis → |
| Austroargiolestes icteromelas → | Hemicordulia continentalis → |
| Platycnemididae | Hemicordulia intermedia → |
| Le genre Nososticta en Australie → | Pentathemis membranulata → |
| Nososticta baroalba → | |
| Nososticta coelestina → | Austrocorduliidae |
| Nososticta fraterna → | Austrophya mystica → |
| Nososticta kalumburu → | |
| Nososticta koolpinyah → | Macromiidae |
| Nososticta koongarra → | Macromia tillyardi → |
| Nososticta liveringa → | |
| Nososticta mouldsi → | Libellulidae |
| Nososticta solida → | Aethriamanta circumsignata → |
| Nososticta solitaria → | Aethriamanta nymphaea → |
| Isostictidae | Agrionoptera insignis allogenes → |
| Austrosticta fieldi → | Agrionoptera longitudinalis → |
| Austrosticta soror → | Brachydiplax denticauda → |
| Eurysticta coomalie → | Brachydiplax duivenbodei → |
| Lithosticta macra → | Camacinia othello → |
| Neosticta fraseri → | Crocothemis nigrifrons → |
| Oristicta filicicola → | Diplacodes bipunctata → |
| Rhadinosticta banksi → | Diplacodes haematodes → |
| Coenagrionidae | Diplacodes nebulosa → |
| Aciagrion fragile → | Diplacodes trivialis → |
| Agriocnemis argentea → | Hydrobasileus brevistylus → |
| Agriocnemis dobsoni → | Lathrecista asiatica → |
| Macrodiplax cora → | |
| Agriocnemis pygmaea → | Nannodiplax rubra → |
| Agriocnemis rubricauda → | Nannophlebia eludens → |
| Argiocnemis rubescens → | Nannophlebia injibandi → |
| Austroagrion exclamationis → | Nannophlebia mudginberri → |
| Austroagrion watsoni → | Nannophlebia risi → |
| Austrocnemis maccullochi → | Neurothemis oligoneura → |
| Neurothemis stigmatizans → | |
| Austrocnemis splendida → | Notolibellula bicolor → |
| Ceriagrion aeruginosum → | Orthetrum balteatum → |
| Ischnura aurora → | Orthetrum caledonicum → |
| Ischnura heterosticta → | Orthetrum migratum → |
| Ischnura pruinescens → | Orthetrum villosovittatum → |
| Pseudagrion cingillum → | Orthetrum sabina → |
| Pseudagrion ignifer → | Orthetrum serapia → |
| Pseudagrion jedda → | Pantala flavescens → |
| Pseudagrion lucifer → | Rhodothemis lieftincki → |
| Pseudagrion microcephalum → | Le genre Rhyothemis ► |
| Rhyothemis braganza → | |
| Teinobasis rufithorax → | Rhyothemis graphiptera → |
| Xanthagrion erythroneurum → | Rhyothemis phyllis → |
| Petaluridae | Rhyothemis princeps → |
| Petalura ingentissima → | Rhyothemis resplendens → |
| Telephlebiidae | Tetrathemis irregularis → |
| Austroaeschna speciosa → | Tholymis tillarga → |
| Telephlebia tillyardi → | Tramea loewii → |
| Aeshnidae | Urothemis aliena → |
| Adversaeschna brevistyla → | Zyxomma elgneri → |
| Anax gibbosulus → | Zyxomma petiolatum → |
| Anax guttatus → | |
| Anax papuensis → | |
| Austrogynacantha heterogena → | |
| Dromaeschna forcipata → | |
| Gynacantha dobsoni → | |
| Gynacantha nourlangie → | |

Bravo pour votre site .Aimant les voyages et les odonates, je prends ces derniers en photo quand je les rencontre . Votre site est precieux pour s’amuser à mettre un nom sur mes decouverte , mais j’avoue que c’est difficile pour un non initié . J’ai entre autres une libellule (prise non loin de Ka kadu parc)de morphologie identique à votre Caminacina
mais avec des ailes beiges parsemées de taches marrons . Serait ce la femelle dont vous parlez dans votre commentaire ?
Bonjour,
Je ne peux pas vous dire vous dire de quelle espèce il s’agit, il vaudrait mieux m’envoyer la photo par mail si vous souhaitez que je l’identifie.